
I Concurso Bioterios.com: Artículo ganador
Articulos Cientificos 01 May 2013Implementación de la técnica inmunoensayoenzimática ELISA como método de diagnóstico para la detección de Syphacia obvelata en ratones producidos para uso experimental
Mileyna Gudiño*, De Jesús Rosa*, Andrés Osorio*, Haydee Urdaneta**, Nacarid Alfonzo **, Yaneth Mora *** y James O´Callaghan*.
*Bioterio de la Universidad de Los Andes. Mérida. Venezuela.
** Instituto de Inmunología “Louis Pasteur”. Instituto Autónomo Hospital Universitario
*** Instituto de Estadística
The purpose of the present paper is to report the diagnosis of the Syphacia obvelata with the ELISA technique in experimental mice. The Syphacia obvelata was obtained from positive stool samples of mice previously infected with the parasite´s eggs via oral, these were monitored for observed the adult parasite with graham test and by the presence in the colon and cecum portions of intestine. The crude antigen was prepared from these whole parasite. The parasites (600 worms), were washed and crushed by sonication and the proteins in a concentration of 1 µg/ml were obtained by centrifugation. The positive sera were obtained from animals mated outside the production area in minimum maintenance conditions: with the food and water non-steril were placed ad libitum and the lodging (paddy rice) was changed weekly. The pups were weaned to one month after birth, and kept in boxes T3 (40x24x15) cm3. The negative sera were obtained from male mice C57BL/6 of two months old, kept in isolaters with positive pressure and all the inputs sterilized, the infection was checked by graham test and necropsy. For the standardization of the ELISA technique were using 0,0035 optical density units as a cut off value was considered positive serum and using 0,0024 were considered negative sera as other cut off. The evaluation done presented that 61 of 72 sera of mice had a positive ELISA test. Thus, the ELISA presented a 95,3% of sensibility and 100% specificity. The results obtained are similar with those found by other investigators with others similar parasites, the ELISA test is a useful tool for the diagnosis for Syphacia obvelata because the animal is not sacrifice for to realize the diagnosis of these parasite and is very much inexpensive in relation to job/ man/hour when to talk of colonies with many animals.
Key words: ELISA technique, Syphacia obvelata, mice, parasite, animal facilities.
INTRODUCCIÓN
Entre las parasitosis intestinales de mayor incidencia en los ratones de laboratorio, la oxiuriasis producida por Syphacia obvelata es considerada como la infección parasitaria más extendida en los animales producidos en los bioterios1-2-3. Se estima que aproximadamente un 99% de la población de roedores de un bioterio con mínimas barreras están infectados por este nematodo4-5-6, y la morbilidad con sintomatología evidente, es observada en todos los casos donde se confirme su existencia7-8-9-10-11. Syphacia obvelata es un helminto nematodo de la familia oxyuridae y en su prevalencia intervienen factores como la edad, sexo y situación inmunitaria12.
La forma de contagio ha sido descrita por numerosos autores, resumidamente: los ratones se infectan por la ingestión de huevos del medio. Esos huevos pasan a través del estómago y eclosionan en el intestino delgado de allí emergen las larvas que migran al colon y ciego donde evolucionan a adultos; en este estadio se fecundan las hembras, que migran luego al exterior para depositar los huevos en la región perianal13-14-15. El método más conocido para diagnosticar este oxiuro es el de la cinta adhesiva o método de Graham, pero el mismo, solo permite visualizar los huevos, más no los adultos. Este método puede reportar falsos negativos si no se coloca la cinta de manera correcta en el ano.
La técnica ELISA ha sido estandarizada para realizar el diagnóstico de nematodos como: la Toxocariasis16 y Trichinella17, entre otros.
Las experiencias previas antes mencionadas, sirven de base para indagar sobre la posibilidad de lograr el diagnóstico de la S. obvelata mediante la técnica inmunoensayo enzimática ELISA, de manera de poder monitorear las colonias de ratones y detectar la infección por este nematodo sin tener que sacrificar los animales, en los casos de no encontrar los huevos mediante la técnica de Graham.
El propósito de este trabajo es entonces, estandarizar la técnica de ELISA, con la finalidad de diagnosticar S. obvelata en los ratones de laboratorio, lo que permitirá contar con una nueva herramienta para el diagnóstico de esta parasitosis, y ayudar a controlar este parásito recurrente dentro de los bioterios para ofrecer al investigador un animal con calidad sanitaria y obtener resultados reproducibles.
MATERIALES Y MÉTODOS
SUEROS
Sueros positivos
El suero positivo usado fue proveniente de 57 BALB/c fueron destinados como controles positivos. Los mismos se infectaron vía oral con huevos embrionados de Syphacia obvelata, y comprobada la presencia de los parásitos mediante la técnica de la cinta adhesiva o graham y necropsia con disección del colon y ciego.
Sueros Negativos
Los sueros usados como controles negativos fueron de 8 ratones machos C57BL/6 de 2 meses de edad, mantenidos en aisladores con presión positiva y todos los insumos autoclaveados y comprobada la ausencia del parásito mediante evaluación de las heces por la prueba de graham y disección del colon y ciego.
Sueros problemas
Los sueros problemas fueron procedentes de los 72 animales de 2 meses de edad, pertenecientes a las cepas C57BL/6, BALB/c y a la línea NMRI; provenientes del área de producción del bioterio. Estos animales se producen y mantienen bajo barreras: agua, alimento, lecho autoclaveado, luz ultravioleta en los pasillos, el personal usa mono quirúrgico, guantes, tapabocas, tapapies y gorros, presión positiva dentro de la instalación; además, se siguen procedimientos operacionales normatizados.
Antígeno
Se preparó un extracto proteico a partir de 600 parásitos completos. Los parásitos fueron lavados y congelados. Posteriormente descongelados y centrifugados en una centrifuga refrigerada modelo OPR 6000), a 2000 rpm x 5 minutos. Se recolectó el sedimento contentivo de los parásitos en un solo tubo y se le adicionó formol al 10% y 10 ml de PBS 7.2 de pH.
Se realizaron posteriormente 5 lavados con 30 ml. de PBS, el primer lavado tuvo una duración de 10 minutos y los restantes de 5 minutos cada uno. Posteriormente se observó el pellet al microscopio para corroborar que los parásitos estuviesen libres de bacterias. Los parásitos fueron resuspendidos en 2 ml de PBS, más 2 mM/mol de inhibidores de proteasas cuya mezcla contenía: P- hidroximercuribenzoato (pHMB); fenilmetil sulfonil fluoreto (PMSF) y N-L-P-tosil-fenilalanina clorometil cetona (TPCK). Luego se congelaron los parásitos durante 12 horas hasta su uso.
Prueba de ELISA
Se siguió lo descrito por Huapayai, y col., (2002) para el Strongiloides stercoralis y se usó el protocolo usado en el Instituto de Inmunología del Hospital Universitario de los Andes. Resumidamente: se sensibilizaron placas de microtitulación de poliestireno marca NUNCLONTM surface, fondo plano con el extracto total del antígeno S. obvelata, a una concentración de 1 µg por pozo, diluido con 100 µl de buffer carbonato – bicarbonato pH 9,6. Las placas fueron incubadas por 18 horas a 4ºC tapadas y protegidas para evitar la evaporación. Se preparó el buffer de lavado PBS al 0,05% de Tween 20 (PBS-T) y PBS-T al 2% de caseína (PBS-TC). Las placas fueron lavadas con PBS-T a pH 7.2 sin rebozar en los pozos y palmando cada cubeta vigorosamente sobre un papel absorbente. A cada pozo se le añadió 100 µl de PBS-T y leche descremada al 2% (PBS-TC) y fueron incubados por 1 hora para bloquear los sitios libres de proteínas en el plástico. Las placas fueron de nuevo lavadas con PBS-T y para ser utilizadas o para ser almacenadas a -20ºC hasta su utilización. Posteriormente los sueros a temperatura ambiente, fueron diluidos en (PBS – TC) y colocados en cada pozo, en las siguientes diluciones 1:64, 1:128, 1:256 y 1:512 en volúmenes de 100 µl por pozo. Luego se procedió a lavar 5 veces con PBS-T. Posteriormente se colocó el conjugado IgG (anti Mouse marca Sigma) peroxidasa en una dilución de 1:1000 con PBS T-C en volúmenes de 100 µl en cada pozo y se incubó por una hora a 37ºC. Se lavó 5 veces las placas con PBS – T y se añadió a cada pozo una solución de sustrato conteniendo buffer citrato fosfato pH 5 y ortofenil-dietanolamina (OPD) al 0.02% con peróxido de hidrógeno H2O2 al 30%, se incubo protegido de la luz por 45 min. a temperatura ambiente. Se detuvo la reacción mediante la adición de 50 µl de ácido sulfúrico H2SO4 al 20%. Se leyeron las placas en el lector de ELISA, utilizando un filtro de lectura a 492 nm. Todas las determinaciones se realizaron por duplicado. Los resultados obtenidos fueron de tipo colorimétrico y cualitativo, se tomaron como positivas a aquellas muestras en la que ocurrió un cambio de color de un anaranjado oscuro a otro de menor intensidad.
Análisis Estadístico
-
Determinación del valor de corte: para la obtención del punto de corte o “cutoff” el cual es el valor de la densidad óptica que determina si la prueba realizada es positiva o negativa se sumaron y promediaron los valores de DO hallados para el control negativo, al valor obtenido más el promedio se le sumaron ± dos desviaciones estándar. Se consideraron positivos los valores de densidad óptica de las muestras problemas que estuvieran sobre el valor del punto de corte, y negativo si el valor obtenido en la densidad óptica de una muestra problema estaba por debajo del valor del punto de corte.
-
Determinación del valor diagnóstico: para ello se usaron criterios preestablecidos (verdaderos positivos, verdaderos negativos, falsos positivos y falsos negativos) que posteriormente permitieron calcular la sensibilidad, la especificidad y la prevalencía de la prueba mediante la prueba de oro o de fiabilidad.
Los valores obtenidos fueron sometidos a un análisis estadístico de correlación utilizando un software estadístico especializado (SPSS) versión 12.0 año 2006 con un 95% de confiabilidad estadística y con una p < 0,05.
RESULTADOS Y DISCUSIÓN
En el presente estudio se logró la estandarización de una técnica de ELISA, la cual pudiese ser implementada como una técnica para realizar el monitoreo parasitológico de Syphacia obvelata en colonias de producción e investigación de ratones producidos con la finalidad de ser utilizados como modelos experimentales.
En la Tabla I, se pueden observar los resultados obtenidos en la prueba de Graham, con respecto a la presencia de huevos en la cinta adhesiva cuando se observaron en el microscopio.
TABLA I
Resultados obtenidos en la prueba de Graham
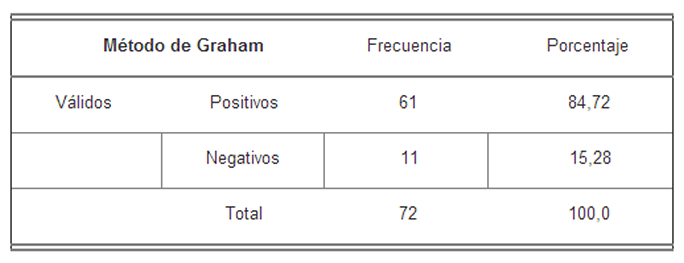
En esta tabla se puede observar que la frecuencia de ratones infectados con el parásito, es de 61 para un porcentaje de 84,72%; estos ratones resultaron positivos al ser evaluados mediante la cinta adhesiva.
En la Tabla II, se presentan los resultados obtenidos al realizar las necropsias, en ésta se puede observar la cantidad de animales en los cuales se observaron los parásitos a nivel del colon y el ciego.
TABLA II
Resultado de presencia de parásitos en el colon y ciego en las necropsias
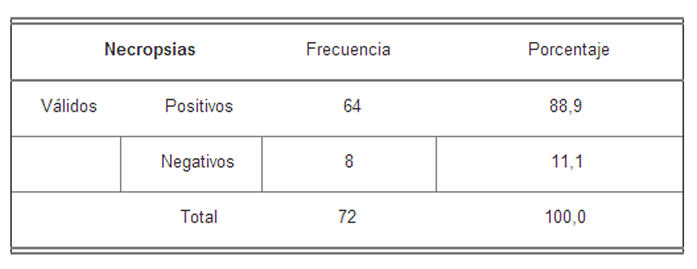
Se puede observar en la tabla que la frecuencia de los ratones infectados fue de 64, ratones.
Al realizar la correlación de los resultados, entre los ratones verdaderos positivos, verdaderos negativos, falsos positivos y falsos negativos, para ambas técnicas (prueba de Graham y necropsias), se encontró que la frecuencia de ratones verdaderamente infectados de 72, fue de 59 ratones, los verdaderamente positivos fue de 8; encontrándose 2 ratones falso positivo ( presencia de huevo en la cinta, ausencia de parásitos en el contenido intestinal), y 3 ratones falsos negativos (ausencia de huevos en la cinta adhesiva, presencia de parásitos en el contenido intestinal)
Con estos datos se calculó: la sensibilidad, la especificidad, los valores predictivos positivos y negativos, la eficiencia y la prevalencía de la técnica convencional, encontrándose los siguientes valores: sensibilidad (positividad): 95,16%, la especificidad (negatividad): 80, 0%, el valor predictivo positivo: 96.76%, el valor predictivo negativo: 72,7% , la eficiencia: 93.05% y la prevalencia: 84,7%
En relación a la prueba de ELISA, se consideraron valores seropositivos, en el límite de positividad o el punto de corte, aquellos resultados cuya densidad óptica superaba la media del valor negativo más 2 desviaciones estándar, el punto de corte estuvo comprendido entre un rango de 0.0035 - 0.024, entonces se consideraron positivos todos los sueros que dieron niveles de anticuerpos mayores a esta máxima lectura de densidad óptica. De esta manera se diferenció entre sueros negativos y positivos.
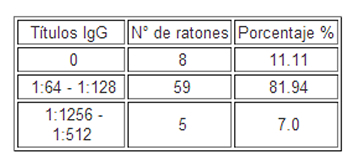
En la Tabla III, se representa el porcentaje de los diferentes títulos de anticuerpos anti S. obvelata obtenidos observando, mayor porcentaje en los títulos de 1:64 – 1:128, indicando que valores de densidad óptica superiores a 0,024 correspondiente a la dilución 1:64 representan los sueros positivos.
TABLA III
Representa el porcentaje de los diferentes títulos de anticuerpos anti S. obvelata
Los resultados obtenidos al realizar el Análisis de fiabilidad (conocido también como la Prueba de Oro), para encontrar la relación entre las pruebas coproparasitológicas y la prueba de ELISA, se reflejan en la Tabla IV.
TABLA IV
Análisis de fiabilidad para encontrar la relación entre las pruebas coproparasitológicas y la prueba de ELISA
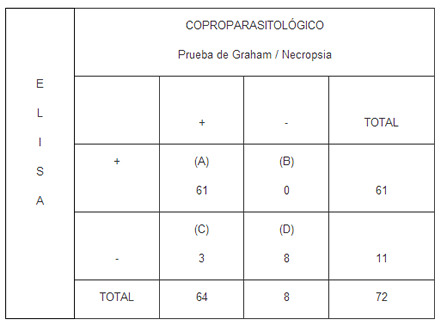
Criterios utilizados: A: Verdaderos positivos. B: Falsos positivos. C: Falsos negativos y D: Verdaderos negativos.
Prevalencia 84,72%; Sensibilidad 95,3%; Especificidad 100% .
La estadística aplicada permitió observar que la eficiencia y la prueba de fiabilidad de la técnica ELISA fue de 93.05% y 95.3% respectivamente, considerándose entonces que la prueba de ELISA puede ser usada como método de diagnóstico para evaluar el grado de la parasitosis causada por Syphacia obvelata en ratones criados para uso experimental. Al comparar los valores de sensibilidad, especificidad, el valor predictivo positivo y negativo encontrados para la prueba ELISA aplicada con los valores encontrados para las pruebas de los análisis convencionales (prueba de graham y necropsias); los resultados observados presentan una sensibilidad de 95.1% para las pruebas convencionales, y para la prueba de ELISA se observó un 95,3% de sensibilidad, señalando entonces que la prueba ELISA es más sensible que las pruebas de rutina.
Con respecto a la especificidad, el método de graham y las necropsias el porcentaje de negatividad fue de 80% y para prueba ELISA fue del 100% demostrando la alta efectividad para señalar de esta última para determinar los animales verdaderamente negativos (DO superiores a 0.0035). Los resultados obtenidos en este trabajo fueron comparados con los obtenidos en trabajos realizados con otros parásitos, observándose semejanzas en los resultados18.
El criterio de positividad para todas las DO mayores al rango del promedio de los controles negativos más dos desviaciones estándar (DO inferiores a 0.024)18.
La implementación de la técnica ELISA permitiría realizar el diagnostico de la presencia de S. obvelata en ratones producidos para la investigación con una alta especificidad, lo que permite realizar el monitoreo de gran número de animales sin sacrificarlos y con la probabilidad de un 96,7% de positividad.
REFERENCIAS
-
Hoag W. Oxyuriasis in laboratory mouse colonies. Am. J. Vet Res. 1961. 22, 150-153.
-
Mullink J W M. Pathological effects of oxyuriasis in the laboratory mouse. Lab Anim. 1970. 4: 197-201.
-
Flynn, R. Parasites of laboratory Animals. (eds). Ames, Iowa: Iowa State University press. 1973.
-
Taffs L F. Pinworms infections in laboratory rodents a Review. Lab Anim. 1976. 10: 1-13.
-
Flynn B M., Brown, P A.. Treatement of Syphacia obvelata in mice using ivermectin. Lab Anim. Sci. 1989. 39: 41-52
-
Coghlan L G, Lee D R, Psencik B. Practical and effective eradication of pinworms (Syphacia muris) in rats by use of fenbendazole. Lab Animal Sci. 1993. 43: 481-487.
-
Huerkamp M J, Benjamin K A, Zitzow L A. Fenbendazole treatment without environmental decontamination, eradicates Syphacia muris from all rats in a large, complex research institution. Contemp Top Lab Anim Sci. 2000. 39: 9-12.
-
Jacoby R O, Fox J G, Davisson M. Biology and diseases of mice. Lab Animal. Medicine, Academic press. 2002. 2: 35-120.
-
Livingston R S, Riley L K. Diagnostic testing of mouse and rat colonies for infections diseases. Lab Anim. 2003. 32: 44-51.
-
Scaini C, Teixeira M, Traversi M, Rheinganstz M, Signorini V. Helmintos de ratos wistar de diferentes faixas etárias criados em bioterio conventional. Arq. Inst. Biol.2003.3:265-268.
-
Bazzano T, Restel T, Pinto R M, Gomes, D C. Patrones de infección con los nemátodos de S. obvelata. A. tetráptera en ratones de tipo convencional. Memorias del Instituto Oswaldo Cruz. 2002. 97: 97-103.
-
Zuñiga J, Tur Marí J, Milocco S, Piñeiro R.. Ciencia y Tecnología en protección y experimentación animal. (eds) McGRAW-HILL/INTERAMERICANA DE ESPAÑA, SAU. 2001.
-
Bressman M C R, Calgaro G A, Alexandre S R, y Márquez T. . Prevalence of ecto and endoparasites in mice and rats reared in animals houses. Vet. Res. Anim Sci. 1997. 34: 142-146.
-
Graham C F. Device for diagnosis of Enterobius infection. Am. J. Trop. Med. 1941. 27: 39-46.
-
Higgins O, Dettman C, Dingle C, Anderson B, Becker P. Intestinal parasites of conventionally maintained BALB/c mice and Mastomys coucha and the effects of a concomitant schistosomic infection. Lab Anim. 1990. 24:246-252.
-
Espinoza Y, Huapaya P, Suárez R, Chávez V, Sevilla C, Dávila E, Huiza A, Naquira C, Alva P. Estandarización de la técnica de ELISA para el diagnóstico de Toxocariasis humana. Anales de la Facultad de Medicina. Universidad Nacional Mayor de San Marcos. 2003. 64:7-12.
-
Contreras M, Acevedo E, Aguilera S, Sandoval L, Salinas P. Estandarización de ELISA IgM e IgA para el inmunodiagnóstico de triquinosis humana. Bol. Chil. Parasitol. 2000. 54: 3-4.
-
Huapayai P, Espinosa I, Huaiza A, Savilla C. Estandarización de la técnica de ELISA para diagnóstico de Estrongiloidiosisa. Anales de la Facultad de Medicina Universidad Nacional Mayor de San Marcos. 2002. 63: 3-5.
AGRADECIMIENTO
Trabajo realizado con el financiamiento del Centro de Desarrollo Científico y Humanístico de la Universidad de Los Andes (CDCHT-ULA) con el número C- 1450-07-03-B. Al Laboratorio del Instituto de Inmunología “Louis Pasteur” IAHULA.


















Comentarios