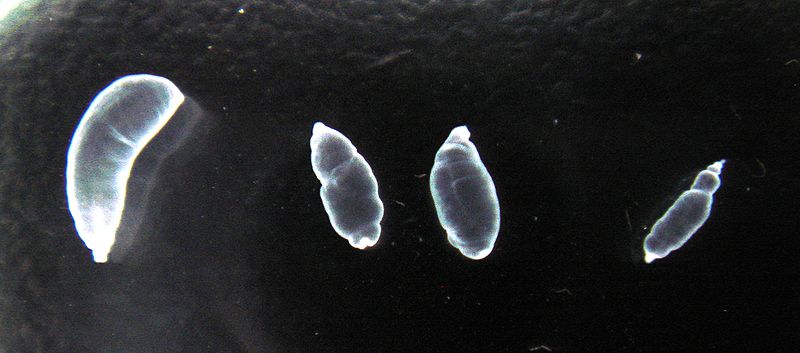
Cultivo de larvas en ratones para la obtención de antígeno
Articulos Cientificos 01 May 2013Cultivo de larvas de Taenia crassiceps en ratones BALB/c para la obtención de antígeno para inmunodiagnóstico
SP Agudelo L1, LE. Botero P1,2, JG Restrepo S1 y JF Florez2,3
Grupo Interdisciplinario para el Estudio de las Parasitosis Intestinales - GIEPI1
Corporación de Ciencias Básicas Biomédicas2
Departamento de Educación Médica Grupo Informática Médica3
Universidad de Antioquia
Correspondencia: SP Agudelo L. GIEPI, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Carrera 51 D No. 62 – 29. Tel.: 57 4 219 60 55
e-mail: pilaragudelo@yahoo.com
Resumen
Los antígenos de cisticercos de Taenia solium (T. so) tienen una impresionante homología con los antígenos de Taenia crassiceps (T.cra), ventaja que posibilita el uso de estos como un substituto de los cisticercos de T.so, ya que son reconocidos de forma cruzada por los anticuerpos de los pacientes con cisticercosis Adicionalmente se presentan escasas infecciones en humanos por T.cra, y la obtención de grandes cantidades de cisticercos de T.cra resulta económica y simple a través de un modelo experimental de infección en ratones.
En este reporte, 97 ratones hembras BALB/c, de 6 a 8 semanas de edad con un promedio de peso corporal de 21 g fueron inoculadas dentro de la cavidad peritoneal con 8 a 10 cisticercos T.cra de la cepa ORF. Posterior a la infección, se mantuvieron en el bioterio de la Facultad de Medicina de la Universidad de Antioquia, asegurando la disponibilidad de agua y alimento con periodos de luz y obscuridad de 12 horas cada uno. Los animales se pesaron dos veces por semana y se evaluaron las condiciones físicas y comportamentales durante la infección.
Después de la inoculación de los cisticercos el tiempo promedio para alcanzar el desarrollo de la infección fue de 40 días. Durante este tiempo el peso corporal tuvo una ganancia que representa un incremento del 44% comparado con el peso inicial del ratón. La tasa de infección estuvo entre el 66% y el 100%. Al finalizar la infección y aplicar la eutanasia fue posible recuperar un promedio de 482 cisticercos por animal. Durante el tiempo que demoró el desarrollo de la infección las condiciones fisiológicas de los animales no se vieron alteradas, logrando establecer, de esta forma, en nuestro laboratorio el cultivo de cisticercos de T cra y una fuente alternativa de antígeno para el inmunodiagnóstico de la cisticercosis tanto humana como porcina.
Palabras Claves: Taenia crassiceps, Cisticercos, Taenia solium, BALB/c, cisticercosis.
INTRODUCCIÓN
La alta prevalencia de la cisticercosis humana y porcina como una enfermedad grave y frecuente en países en desarrollo tiene elevados requerimientos de antígenos de Taenia solium (T. so) tanto para el diagnóstico de la enfermedad como para la investigación. La preparación de extractos antigénicos adecuados en cantidades suficientes para el diagnóstico de la cisticercosis está aun ligado a la obtención de cerdos naturalmente infectados con cisticercos de T.so, los cuales usualmente se encuentran en condiciones clandestinas haciendo difícil de localizarlos, interfiriendo en la producción de antígeno a gran escala y requiriendo de procedimientos especiales para la purificación específica de antígeno. De otro lado, antígenos sintéticos de T.so no están disponibles en países en desarrollo por sus altos costos, no financiados por entes gubernamentales (1, 2)
Taenia crassiceps (T.cra) (Zeder, 1800; Rudolphi, 1810) es un céstodo cuya forma adulta se encuentra en el intestino de zorros rojos (Vulpes vulpes) de Europa y de Norte América. El estado larvario, cisticercus longicollis (Rudolphi, 1819), se desarrolla en pequeños roedores, los cuales adquieren la infección por la ingestión de los huevos que se encuentran en las heces de los zorros rojos. En los roedores, los cisticercos pueden multiplicarse asexualmente produciendo gemas en su polo abscolex (3). Posteriormente, el zorro rojo caza y come un roedor pequeño con lo que adquiere los cisticercos y desarrolla la forma adulta de la Taenia en su intestino y comienza a expulsar los huevos en las heces. Varias cepas de T. cra han sido aisladas y mantenidas bajo condiciones de laboratorio (3-5), y la cepa ORF ha sido una de las mas ampliamente utilizadas debido a su capacidad para multiplicarse rápidamente en la cavidad peritoneal del ratón (3, 6).
La reactividad antigénica cruzada entre cisticercos de T. so y T. cra (7) ha permitido el uso de antígenos de T. cra para la detección de anticuerpos en muestras de líquido cefalorraquídeo y suero provenientes de humanos y de muestras de suero de cerdos con cisticercosis por T. so (1, 2, 8-18).
Las principales ventajas del cultivo in vivo de cisticercos de Taenia crassiceps en ratones BALB/C como una fuente de antígenos para el inmunodiagnóstico de la cisticercosis son:
-
El modelo experimental murino se convierte en una fuente de cisticercos de T. cra, evitando el requerimiento de cerdos infectados con T.so.
-
El costo de la producción del antígeno es mínimo puesto que los cisticercos de T. cra pueden crecer y permanecer por largo tiempo en ratones de laboratorio (16).
-
La posibilidad de mantener y controlar condiciones estándar para la obtención y procesamiento de los antígenos, asegura la estabilidad y reproducibilidad de las pruebas donde aquellos antígenos podrían ser utilizados (19).
Nuestro objetivo es establecer las condiciones óptimas y mantener un modelo animal para obtener cisticercos de T.cra como fuente de antígeno sustituto de T.so para el inmunodiagnóstico de la cisticercosis en pacientes humanos y en cerdos infectados de nuestro país (Colombia).
METODOLOGÍA
Ratones: Todos los ratones fueron obtenidos del bioterio de la Sede de Investigaciones Universitaria de la Universidad de Antioquia (Medellín, Colombia). Para cada repique, se utilizaron grupos de 12 ratones hembras BALB/c, entre 6 a 8 semanas de edad. El promedio del peso corporal de los animales fue de 21.29 g. Todos los experimentos fueron llevados a cabo siguiendo las recomendaciones del Comité de ética para el Cuidado y el Uso de Animales de Laboratorio de la Universidad de Antioquia y acorde con las Leyes Colombianas en Experimentación Animal.
Mantenimiento: Grupos de 4 ratones marcados individualmente se mantuvieron en cajas plásticas de 30*25*15 cm. Los ratones fueron marcados tiñendo sus orejas con acido pícrico y asignando un código de acuerdo al número de la caja y número de experimento. Las camas fueron hechas de viruta previamente esterilizado. La temperatura promedio a la cual se mantuvieron los animales fue de 24°C, con una humedad relativa del 71% y con ciclos naturales de luz de aproximadamente 12 horas. La alimentación (Rodentina ®) y agua fueron ofrecidos ad libitum.
Parásitos e infección: La infección experimental en los ratones se logró mediante la inoculación de 8 a 10 cisticercos pequeños no gemantes de la cepa ORF de T. cra en la cavidad peritoneal del ratón utilizando una jeringa tuberculina (Rymco®) con una aguja 18G x 1” – 25 x 1,2 mm (Nymco®). Los cisticercos del inóculo estaban resuspendidos en 0.3 ml – 0.4mL de solución fosfato salino tamponado al 1% (PBS) (BioWhittaker®), pH de 7.2 y con adición de antibióticos (gentamicina 40μg/mL, Sigma G 1272). La cepa ORF de T.cra fue gentilmente donada por Dr Adelaide J. Vaz, laboratorio de Inmunología Clínica, Facultad de Ciencias Farmacéuticas, Universidad de Sao Paulo, Sao Paulo, Brasil.
Valoración de los ratones: Los ratones fueron monitoreados diariamente en cuanto a su condición de salud general y de comportamiento. Dos veces por semana se determinó el peso corporal usando una balanza Ohaus Navigator (Mod. 4210), su temperatura utilizando una termometro rectal HH-25KF Thermometer ΩE® (Omega Engineering, Inc.) y las condiciones físicas generales.
Determinación del Punto Final: Cuando los ratones hembras adquirían la apariencia física del final de la gestación, se determinaba el punto final, es decir, se seleccionaban para someterlas a vapores anestésicos, eutanasia por dislocación cervical y posteriormente la extracción de los cisticercos mediante lavado de cavidad peritoneal.
Obtención y selección de los cisticercos de T.cra: Para la extracción de los cisticercos, los procedimientos de lavado de cavidad peritoneal se realizaron en cámara de bioseguridad. Así, una vez cada animal fue sometido a eutanasia, se impregnó todo el pelaje con una solución antiséptica de alcohol al 70%, luego fue fijado a una tabla de disección y se inyectaron 3 mL de PBS estéril dentro de la cavidad peritoneal. A continuación se hizo una incisión de 0.5 cm en la pared abdominal y se extrajeron los cisticercos, succionando varias veces y depositando el material recolectado en tubos Falcon® estériles. Una vez recolectados los cisticercos, se evaluaron macroscópicamente los órganos del ratón para determinar si había alguna clase de daño atribuible al desarrollo de los cisticercos. Estudios histopatológicos no se realizaron en ninguno de los experimentos.
Los cisticercos fueron lavados tres veces con PBS estéril con antibióticos, luego fueron depositados en una caja de Petri para seleccionarlos de acuerdo a su aspecto macroscópico como densos (mayor densidad y opacidad óptica) o como viables (mayor brillantez y transparencia), haciendo un conteo final del total de cisticercos viables y determinando su peso neto (sin PBS). Finalmente, dos lavados adicionales fueron realizados antes de ser inoculados nuevamente o de obtener extracto antigénico.
Análisis Estadístico: La información recolectada fue procesada utilizando Graph Pad Software, Versión 4.00, y Microsoft ® Excel 2003. El análisis estadístico que se realizó fue para un estudio de tipo descriptivo.
RESULTADOS
Éxito de la Inoculación: La cepa ORF de T cra fue inicialmente inoculada en trece ratones hembras BALB/c. Sólo el 30% de los ratones inoculados fueron exitosamente infectados (Tabla 1). Después de la inoculación inicial, 9 repiques más fueron realizados, incluyendo para esto 97 ratones hembras BALB/c, de los cuales 77 fueron exitosamente infectados. Posteriormente, el éxito en la inoculación fue establecido desde un 66.67% hasta 100% con una producción estable de cisticercos bajo condiciones controladas de crecimiento.
Ganancia de peso de los ratones infectados: El promedio de la ganancia de peso de cada ratón fue de 9.11g +3.48 (d.s.), lo cual corresponde al 44% del peso inicial corporal. Del total del peso ganado, el 65% pudo justificarse por los cisticercos cultivados en la cavidad abdominal de los ratones (Fig.1).
Mortalidad de la Infección con T.cra: Ocho (8.25%) de los 97 ratones infectados, murieron durante el desarrollo de los experimentos. De los ocho, sólo a 4 se les realizó estudio postmortem en el cual se demostró intususcepción para los animales analizados. Ninguno de ellos reveló infección con los cisticercos al momento de la muerte.
Tiempo requerido para la obtención de cisticercos: El tiempo promedio de la infección fue de 40.71 días después de la inoculación intraperitoneal. Durante este tiempo se obtuvo un número significativo de cisticercos (Fig.1), sin poner en riesgo las condiciones de vida de los ratones. Sin embargo, al día 28 después de la inoculación, los cisticercos ya habían iniciado su proceso de gemación en la cavidad abdominal de los ratones inoculados.
Cantidad de Cisticercos por cosecha: El recuento promedio de los cisticercos obtenidos se encuentra descrito en la Tabla 2. Observe que el número de cisticercos obtenidos oscila entre 85 y 1447 cisticercos por ratón con un promedio total de 482 cisticercos obtenidos de la cavidad abdominal.
Efecto de la infección con los cisticercos en la temperatura corporal de los ratones: Además de nuestro objetivo inicial, nosotros decidimos considerar si la temperatura de los ratones estuvo afectada por la infección por T cra. Para ésto, determinamos la temperatura de cada ratón vía rectal dos veces por semana, al mismo tiempo que el peso corporal fuera determinado. La determinación de la temperatura se realizó en los grupos de los ratones del tercer al octavo repique. La temperatura de los ratones estuvo entre el rango normal (36.5 a 38.0ºC). Sin embargo, algunos de los ratones presentaron temperaturas por debajo (35.6°C) o por encima (38.8°C) del rango normal. La temperatura promedio para todos los grupos fue de 37.49°C. No se encontraron diferencias significativas entre infectados y no infectados (Información no mostrada).
DISCUSIÓN
Este es uno de los pocos reportes que describe en detalle el cultivo in vivo de Taenia cassiceps en ratones BALB/c, después del trabajo publicado por Reino S. Freeman en 1962 (3). De ahí que nuestro objetivo fue establecer las condiciones para un modelo animal como fuente de antígeno sustituto de T.so para el diagnóstico de la cisticercosis.
De acuerdo con lo reportado por Freeman (3) los primeros resultados de la infección experimental con T.cra fueron reportados por Braun, M. en 1896 y por Studer, M. y Baer, J.G. en 1949. Freeman encontró que la especie de ratón y el sexo interferían en el desarrollo de la infección con cisticercos de T. cra (3). En su reporte, él hizo ensayos inoculando varias especies de animales encontrando que en hamsters, los cisticercos de T. cra permanecían vivos por más de 65 días sin reproducirse, y en cerdos ellos sobrevivieron entre 14 y 21 días después de la inoculación. En conejos y guinea pigs los cisticercos sufrieron degeneración. En cambio, los cisticercos sobrevivieron y se multiplicaron en los ratones, siendo así usados para experimentos posteriores (3).
Existen reportes que evidencian que la respuesta inmune del hospedero frente al parásito es influenciada por el genotipo del hospedero (20). Así, el desarrollo de T.cra se ve favorecido en ratones de la cepa BALB/c y especialmente en ratones de la subespecie BALB/cAnN, pero por el contrario la cepa de ratones C57BL/6J no permite el desarrollo de los cisticercos (3, 21).
El sexo del hospedero también es un factor importante, puesto que el primer reporte mostró que las hembras más tolerantes a la infección que los machos y esta mayor susceptibilidad parece estar asociada con altos niveles de estrógenos circulantes (6, 22, 23). Un interesante hallazgo fue que la infección crónica con cisticercos de T.cra en ratones machos hizo que ellos perdieran su típica capacidad reproductiva masculina. Los efectos en el sistema reproductivo masculino incluyeron una marcada dilatación y una fibrosis circundante de los testículos y vesículas seminales. En los testículos se observó adicionalmente disminución en los espermatozoides. Los machos sufrieron un proceso de feminización que se caracterizó por la elevación de los niveles séricos de 17 - b estradiol en más de 200 veces por encima de los valores normales en el suero y además por la disminución de los niveles de la testosterona alrededor del 90% por debajo de lo normal (24).
Otro aspecto importante fue determinar la vía de inoculación mas apropiada. De la misma manera, Freeman llevó a cabo estudios en los cuales determinó que después de la inoculación, la recuperación de cisticercos vivos tuvo un mayor rendimiento, es decir, se recuperó un número mayor de cisticercos utilizando la inoculación intraperitoneal (75%) comparado con otras rutas como la subcutánea (55%) o la intrapleural (15%) (3).
Basados en los hallazgos descritos y en la experiencia de otros investigadores (1, 2, 8-18, 25), nosotros decidimos utilizar ratones hembras de la especie BALB/c para inocularles cisticercos de T. cra en la cavidad intraperitoneal.
En nuestro estudio, la tasa de éxito de la infección fue tan alta del 66.67% después de una única inoculación intraperitoneal con 8 a 10 cisticercos pequeños no gemantes, comparado con el 42.4% obtenido por Freeman utilizando la ruta oral para ratones de la misma edad (6 a 8 semanas). Aunque Freeman también exploró y reportó la ruta intraperitoneal, el enfatizó en la ruta oral para la infección y la tasa de reproducción de los cisticercos. Adicionalmente, es bueno resaltar que él utilizó un solo huevo para inocular los ratones en sus experimentos puesto que su objetivo estaba orientado a conocer la biología del parásito, mientras que nosotros utilizamos la vía intraperitoneal utilizando aproximadamente 10 cisticercos para las inoculaciones puesto que necesitábamos una fuente de antígeno apropiada (3)
Nosotros evaluamos el efecto de la infección en la supervivencia de los ratones. Sólo el 8.25% de los ratones inoculados murieron y no se encontró correlación con la infección con los cisticercos al momento de la necropsia. Así mismo, después de cultivar in vivo los cisticercos y realizar la eutanasia para recolectar los cisticercos, el examen macroscópico no mostró compromiso de ningún órgano, indicando no asociación con la infección.
En este reporte, nosotros cosechamos cisticercos a los 40.71 días después de la inoculación. Los cisticercos de T.cra se multiplicaron rápidamente en la cavidad peritoneal de ratones susceptibles. Los ratones inoculados tuvieron una ganancia de peso de cerca del 20% del peso inicial durante 28 días postinoculación. Después de ésto, los ratones que se habían infectado exitosamente incrementaron notoriamente su peso corporal hasta en un 44% del peso inicial, coincidiendo con el momento en que los cisticercos ya se han establecido completamente y habian iniciado su proceso de gemación exponencial confiriendo al ratón hembra el aspecto físico del final de la gestación. Cerca del 65% de la ganancia del peso corporal se pudo justificar por la cosecha de los cisticercos; el resto de la ganancia se debió al crecimiento y desarrollo normal del animal.
Estos hallazgos difieren de los de Freeman en 1962 (3), puesto que en su investigación los cisticercos fueron cosechados desde el día 50 hasta los 553 días, cuando los ratones infectados tuvieron el mencionado aspecto físico del final de la gestación; pero su propósito fue evaluar el desarrollo de la infección como ya lo habíamos mencionado. Adicionalmente en ese reporte, Freeman describe cómo se ven afectadas las funciones fisiológicas del ratón infectado, situación que nosotros no permitimos en ningún momento durante el desarrollo de los ensayos, puesto que así como otros autores nuestro interés era establecer la fuente de antígenos para inmunodiagnóstico (1, 2, 7-17, 19, 26).
La tasa de reproducción de los cisticercos se incrementa con la edad de los mismos, así podemos decir que en infecciones recientes los cisticercos producen menor cantidad de gemas, mientras que en las infecciones crónica hay una mayor tasa de gemación. De esta forma la mayoría de los ratones infectados vía inoculación intraperitoneal por un período mayor de 300 días, alcanzaban a perder su abdomen al punto de tener el aspecto del final de la gestación. De los estudios llevados a cabo por Freeman en 1962, se encontró que un ratón infectado en su cavidad abdominal había vivido 553 días después de la inoculación y había desarrollado un total de 4412 cisticercos (3). Los número de cisticercos recuperados en nuestro trabajo, tuvo un promedio de 482, en un rango desde 85 hasta 1447 (Table Nº2). Contrario a los estudios de Freeman, nosotros solo permitimos el desarrollo de la infección hasta alrededor de los 40 días para evitar las disfunciones fisiológicas de los animales o hasta que el aspecto del final de la gestación fuera alcanzado por los ratones hembras inoculados. La variabilidad en la cantidad de cisticercos obtenido de cada ratón se pudo explicar por el tamaño de los cisticercos que variaban entre un milimetro y hasta un centímetro de diámetro mayor.
Interesantemente observamos que al incrementar el tiempo de infección después de la inoculación mas allá de las 6 semanas, los cisticercos incrementan el número de gemas y la cantidad de aquellos que se clasifican como densos, no siendo este tipo de cisticercos óptimo para el antígeno o para repiques.
De acuerdo con nuestras observaciones, podemos concluir que los ratones que desarrollan de manera óptima la infección con cisticercos de T.cra deben tener una edad entre las 6 y las 8 semanas; la inoculación intraperitoneal debe realizarse con 8 a 10 cisticercos pequeños no gemantes en un volumen de 0.3 – 0.4 mL de PBS estéril. Luego de la inoculación, el momento ideal para obtener el antígeno es alrededor de 6 semanas (40 días) postinfección cuando los ratones han alcanzado un incremento del peso corporal de 44% con relación al peso previo a la inoculación y se refleja con el aspecto físico del estado final de la gestación, sin afectar las funciones fisiológicas de los ratones de laboratorio. Adicionalmente, cuando los cisticercos obtenidos tuvieron un tamaño más grande (mayor de 1 cm), fue posible obtener mayor volumen de fluido vesicular con mayor cantidad de proteína, en promedio 2 mg de proteína/ml (datos no mostrados).
Las condiciones experimentales controladas acá evaluadas y estandarizadas permite la generación de grandes cantidades de cisticercos bajo parámetros homogéneos y a un bajo costo, como alternativa de fuente de antígeno para el diagnóstico de las cisticercosis, para diferentes objetivos de investigación y para laboratorios de diagnóstico.
Agradecimientos
Al CODI (Comité para el Desarrollo de la Investigación), Universidad de Antioquia, por el soporte financiero, al personal del Bioterio de la SIU, Universidad de Antioquia, por proporcionarnos los animales de experimentación y facilitarnos las condiciones de mantenimiento de los animales para el desarrollo de la investigación.
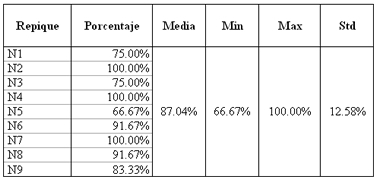
Tabla No 1. Porcentaje de éxito de inoculación. En la primera inoculación de la cepa ORF de T cra, sólo el 30,76% de los ratones inoculados lograron desarrollar la infección (Valor no mostrado en la tabla). Del repique N1 hasta el N9 se tuvieron en cuenta para determinar los valores promedios de la media, el mínimo y el máximo, así como la desviación estándar. Min: mínimo, Max: Máximo, Std: Desviación estandar.
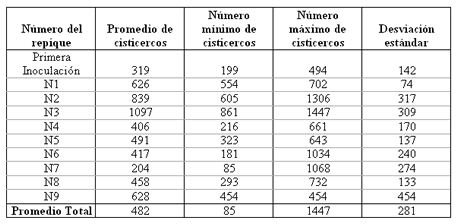
Tabla Nº2. Recuento promedio de cisticercos en cada repique. La inoculación inicial de la cepa ORF no fue incluida en los cálculos matemáticas para la media. Los promedios totales no incluyen la información de la primera inoculación.
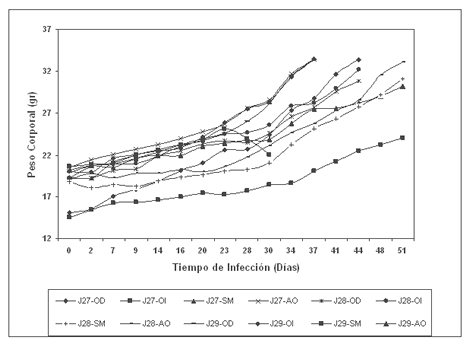
Fig 1. Variación a través del tiempo del peso corporal de los ratones inoculados.
En la gráfica se muestra el repique N°9. Diez de los doce ratones hembras inoculados desarrollaron la infección. Cada línea representa el peso ganado a través del tiempo. El peso promedio final en este repique fue de 31.52 +2.91 (DS) con un promedio de ganancia de peso de 12.87+2.41 g el cual se alcanzó en 44.7+6.13 dias. J29-SM y J29-AO no desarrollaron la infección.
Referencias
-
Bueno EC, Vaz AJ, Machado LD, Livramento JA. Neurocysticercosis: detection of IgG, IgA and IgE antibodies in cerebrospinal fluid, serum and saliva samples by ELISA with Taenia solium and Taenia crassiceps antigens. Arq Neuropsiquiatr 2000;58(1):18-24.
-
Bueno EC, Vaz AJ, Machado LD, Livramento JA, Mielle SR. Specific Taenia crassiceps and Taenia solium antigenic peptides for neurocysticercosis immunodiagnosis using serum samples. J Clin Microbiol 2000;38(1):146-51.
-
Freeman RS. Studies on the biology of Taenia crassiceps (Zeder, 1800) Rudolphi, 1810 (Cestoda). Can J Zool 1962;40:969-990.
-
Everhart ME, Kuhn RE, Zelmer DA. Infrapopulation dynamics of a wild strain of Taenia crassiceps (WFU) (Cestoda: Taeniidae) in BALB/cJ mice. J Parasitol 2004;90(1):79-84.
-
Miyaji S, Oku Y, Kamiya M, Okamoto M, Ohbayashi M, Uchida A, et al. Growth of a Japanese isolate of Taenia crassiceps in intermediate and definitive hosts. Parasitol Res 1990;76(4):351-4.
-
Sciutto E, Fragoso G, Diaz ML, Valdez F, Montoya RM, Govezensky T, et al. Murine Taenia crassiceps cysticercosis: H-2 complex and sex influence on susceptibility. Parasitol Res 1991;77(3):243-6.
-
Larralde C, Montoya RM, Sciutto E, Diaz ML, Govezensky T, Coltorti E. Deciphering western blots of tapeworm antigens (Taenia solium, Echinococcus granulosus, and Taenia crassiceps) reacting with sera from neurocysticercosis and hydatid disease patients. Am J Trop Med Hyg 1989;40(3):282-90.
-
Vaz AJ, Nunes CM, Piazza RM, Livramento JA, Da Silva MV, Nakamura PM, et al. Immunoblot with cerebrospinal fluid from patients with neurocysticercosis using antigen from cysticerci of Taenia solium and Taenia crassiceps. Am J Trop Med Hyg 1997;57(3):354-7.
-
Pardini AX, Peralta RH, Vaz AJ, Machado Ldos R, Peralta JM. Use of Taenia crassiceps cysticercus antigen preparations for detection of antibodies in cerebrospinal fluid samples from patients with neurocysticercosis (Taenia solium). Clin Diagn Lab Immunol 2002;9(1):190-3.
-
Peralta RH, Vaz AJ, Pardini A, Macedo HW, Machado LR, De Simone SG, et al. Evaluation of an antigen from Taenia crassiceps cysticercus for the serodiagnosis of neurocysticercosis. Acta Trop 2002;83(2):159-68.
-
Kunz J, Kalinna B, Watschke V, Geyer E. Taenia crassiceps metacestode vesicular fluid antigens shared with the Taenia solium larval stage and reactive with serum antibodies from patients with neurocysticercosis. Zentralbl Bakteriol 1989;271(4):510-20.
-
Espindola NM, De Gaspari EN, Nakamura PM, Vaz AJ. Cross-reactivity of anti-Taenia crassiceps cysticerci immune antibodies with Taenia solium antigens. Vet Parasitol 2000;89(4):321-6.
-
Espindola NM, De Gaspari EN, Nakamura PM, Vaz AJ. Production of monoclonal antibodies anti-Taenia crassiceps cysticerci with cross-reactivity with Taenia solium antigens. Rev Inst Med Trop Sao Paulo 2000;42(3):175-7.
-
Larralde C, Sotelo J, Montoya RM, Palencia G, Padilla A, Govezensky T, et al. Immunodiagnosis of human cysticercosis in cerebrospinal fluid. Antigens from murine Taenia crassiceps cysticerci effectively substitute those from porcine Taenia solium. Arch Pathol Lab Med 1990;114(9):926-8.
-
Bueno EC, Snege M, Vaz AJ, Leser PG. Serodiagnosis of human cysticercosis by using antigens from vesicular fluid of Taenia crassiceps cysticerci. Clin Diagn Lab Immunol 2001;8(6):1140-4.
-
Garcia E, Ordonez G, Sotelo J. Antigens from Taenia crassiceps cysticerci used in complement fixation, enzyme-linked immunosorbent assay, and western blot (immunoblot) for diagnosis of neurocysticercosis. J Clin Microbiol 1995;33(12):3324-5.
-
Pinto PS, Vaz AJ, Germano PM, Nakamura PM. ELISA test for the diagnosis of cysticercosis in pigs using antigens of Taenia solium and Taenia crassiceps cysticerci. Rev Inst Med Trop Sao Paulo 2000;42(2):71-9.
-
Sciutto E, Aluja A, Fragoso G, Rodarte LF, Hernandez M, Villalobos MN, et al. Immunization of pigs against Taenia solium cysticercosis: factors related to effective protection. Vet Parasitol 1995;60(1-2):53-67.
-
Biondi GF, Mucciolo RG, Nunes CM, Richtzenhain LJ. Immunodiagnosis of swine cysticercosis by indirect ELISA employing a heterologous antigen from Taenia crassiceps metacestode. Vet Parasitol 1996;64(4):261-6.
-
Wakelin D. Genetic control of immunity to helminth infections. Parasitol Today 1985;1(1):17-23.
-
Lopez-Briones S, Lamoyi E, Fragoso G, Soloski MJ, Sciutto E. Taenia crassiceps cysticercosis: immune response in susceptible and resistant BALB/c mouse substrains. Parasitol Res 2003;90(3):236-42.
-
Terrazas LI, Bojalil R, Govezensky T, Larralde C. A role for 17-beta-estradiol in immunoendocrine regulation of murine cysticercosis (Taenia crassiceps). J Parasitol 1994;80(4):563-8.
-
Ferreira AP, Vaz AJ, Nakamura PM, Sasaki AT, Ferreira AW, Livramento JA. Hemagglutination test for the diagnosis of human neurocysticercosis: development of a stable reagent using homologous and heterologous antigens. Rev Inst Med Trop Sao Paulo 1997;39(1):29-33.
-
Morales-Montor J, Gamboa-Dominguez A, Rodriguez-Dorantes M, Cerbon MA. Tissue damage in the male murine reproductive system during experimental Taenia crassiceps cysticercosis. J Parasitol 1999;85(5):887-90.
-
Toledo A, Cruz C, Fragoso G, Laclette JP, Merchant MT, Hernandez M, et al. In vitro culture of Taenia crassiceps larval cells and cyst regeneration after injection into mice. J Parasitol 1997;83(2):189-93.
-
Pinto PS, Vaz AJ, Nakamura PM, Germano PM. Immunoblot analysis using antigen from Taenia crassiceps cysticerci in the diagnosis of swine cysticercosis. Bol Chil Parasitol 2001;56(1-2):36-42.


















Comentarios